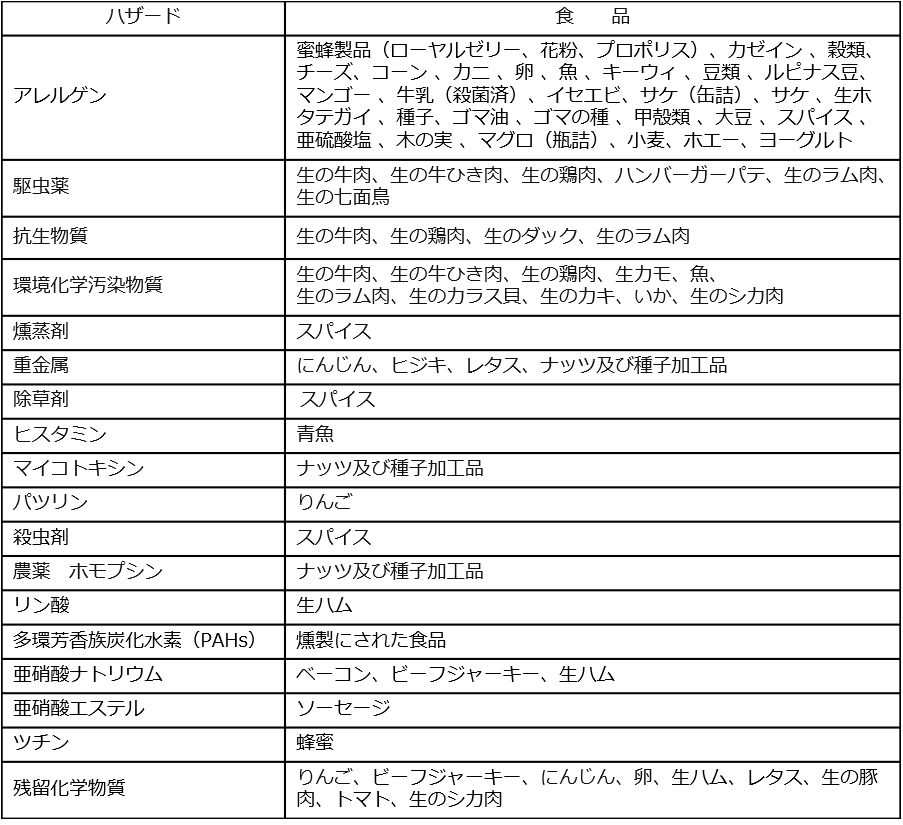
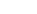化学的・物理的危害要因情報
化学的危害要因
カビ毒(マイコトキシン)
カビが産生する二次代謝産物の中で,人または家畜の健康をそこなう有毒物質であるカビ毒をマイコトキシンと呼び、マイコトキシンによって引き起こされる疾病をかび中毒症又は真菌中毒症と呼んでいる。マイコトキシンによる中毒症は人類の歴史と共に発生していたと考えられる。マイコトキシンによる人の病気に関する最も古くから知られているものは,麦角菌による中毒である。国内でマイコトキシンが注目を浴びるようになったのは,1953年輸入米によって起こった黄変米事件である(角田,1953)。この事件を契機として,我が国におけるマイコトキシンの研究が軌道に乗ってきたのである。マイコトキシンがさらに世界的に注目され,マイコトキシンに関する研究に対しあらゆる意味で新しい時代の扉を開いたのがアフラトキシンの発見である。
文献:
- 角田 廣: 食糧研報, 8, 41-68(1953).
- 宇田川俊一,鶴田 理:かびと食物,医歯薬出版,1975.
- 宇田川俊一編:食品のカビI 基礎編 食品のカビ汚染と危害,幸書房,2004.
- 田中健治,真鍋 勝:植物防疫,246-250(1993).
それぞれのマイコトキシンについて
現在までに化学構造の明らかになったマイコトキシンの数は,300 を超えている。ここでは主要なマイコトキシンについて掲載した。
アフラトキシン
由来
アフラトキシンは,1960年英国で起こった10万羽以上の七面鳥の中毒事件を発端として発見されたマイコトキシンで,強い毒性と発がん性を有している物質である。このアフラトキシンが注目されたのは,天然物質の中で最も発がん性が強いことと,世界的に見て農産物への汚染が広く発生していることである。
産生菌
アフラトキシン産生菌として報告されたものはAspergillus,Penicillium,Rhizopus,Mucor 属と多岐にわたっているが,研究の進んで来た現在では,アフラトキシンを産生する菌は,Aspergillus flavus ,A. parasiticus及びA. nomiusの特定の菌株であることが一般に是認されている。A. flavus菌群は,世界中の土壌,空気中から検出される一般的な菌であるが,アフラトキシンを産生する菌株には地域的分布に差があるようである。それはアフラトキシンの農産物汚染が南米,アフリカ,東南アジアに多く発生しているのに比較して,我が国やヨーロッパの北部地域ではほとんど汚染が発生していないからである。東南アジアおよび日本における土壌中のアフラトキシン産生菌の分布を調べると,アフラトキシン産生菌は本州中部以北には生息できず,本州南部から東南アジアにかけて分布していることがわかった(真鍋ら,1978)。その分布域は,年平均気温16℃より暖かい地域であった。
構造
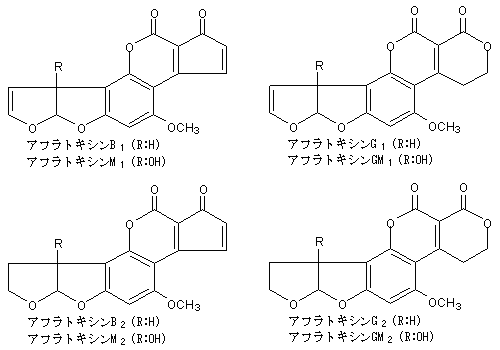
毒性
動物に対する毒性はCが最も強く,以下G1,B2,G2の順である。アフラトキシンの中で一番問題になるのはB1である。しかし,最近外国などの規制を見ると,B1の他にB2,G1,G2を含めた総含量にしているところも多い。Carnaghan らによると,アヒルのひなを用いて経口的に7日でのLD50値を調べると,アヒルひな1匹当たりB1が18.2μg,B2が84.8μg,G1が39.2μg,G2が172.5μgであった。アフラトキシンB1を発癌物質としてよく知られているバターイエローの毒性と比較すると,実に900 倍の強さがある。アフラトキシンB1は,DNAの合成阻害やRNAの代謝阻害を起こすことが,知られている。
汚染
アフラトキシンの自然汚染では,ピーナッツ,トウモロコシ,ブラジルナッツ,棉実に良く認められるが,大豆,小麦,大麦,燕麦,ソルガムはかなり汚染の可能性が少ない。田端らは,1986年から1990年までの市場に出回っている食品についてアフラトキシンの汚染状況を多数の試料について詳細に調べており,上記と同様の傾向を得ている。また,スパイスについては白胡椒,唐辛子,パプリカ,ナツメグに汚染が認められた(田端ら,1993)。このように,農産物の種類により,汚染されやすいものと汚染されにくいものがある。
分析方法
アフラトキシンは,水に溶けにくいため,含水メタノールなどで抽出し,ヘキサンで脱脂し,クロロホルムに転溶させる方法が用いられている。穀物や豆類など多くの農産物に汚染が見られることから,回収率が高い方法,簡易な方法,高感度に検出される方法など目的別に,あるいはその農産物に特有の分析法が考案されている。簡易な方法としては,酵素免疫測定法などの方法があるし,高感度に検出するには,高速液体クロマトグラフィー法などがある。
原料あるいは食品での規制値
アフラトキシンは,強い発がん性と急性毒性を持ち,農産物が汚染されやすく,また現実に汚染が発生していることから,規制値が決められている。我が国においては,ピーナッツ・ピーナッツ製品においては,アフラトキシンB1の値が実態的に10 ppb以下となっている。また飼料については配合飼料中の濃度が10 ppbもしくは20 ppb以下(飼料の種類によって異なる)となっている。世界各国でも規制値が決められている(日本薬学会編,2005)。
危害の除去法
カビ毒一般にいえることであるが,一度汚染されると,除去は難しい。カビの生育しないような条件に,食品および試料などを保つことが必要である。アフラトキシン汚染を防ぐ方法としては,農産物を収穫後速やかに乾燥する方法が,一般的に認められている。A. flavus等が生育しにくい条件だからである。プラスチックバッグの中に、乾燥していない収穫後まもないトウモロコシ粒を入れ、入り口をきつくしばって空気が入らないようにし保存すると、A. flavusの生育が抑えられ、アフラトキシンの産生が抑制されたという報告もある(Kawashima et al.,1990)。飼料用トウモロコシのアフラトキシン汚染防止策としては有効な方法と思われる。
文献
- Kawashima et al.: Proc. Jap. Assoc. Mycotoxicol., 32, 41-46(1990).
- 真鍋 勝ら: Proc. Jap. Assoc. Mycotoxicol., 3/4, 31-35(1976).
- 日本薬学会編.(2005).:衛生試験法・注解 2005,金原出版,pp.266-268.
- Tabata, S. et al.: J. AOAC International,76,32-35(1993).
ステリグマトシスチン
由来
ステリグマトシスチンは,1962年BullockらによってA. versicolorの代謝産物としてその構造が明らかにされた。しかし,A. versicolorのこの代謝産物にステリグマトシスチン(sterigmatocystin)と命名したのは,鳥取大学の初田勇一教授らで,1953年カビの別名Sterigmatocystis versicolor Vuilleminにちなんで名づけられたものである。
産生菌
ステリグマトシスチン産生菌としては,多くの報告があるが,代表的な産生菌としてはA. versicolor,A. nidulansが一般に認められている。この菌は世界に広く分布し,土壌,農作物,特に穀類に広く分布している。
構造
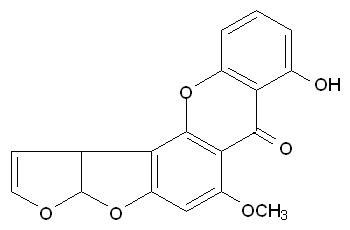
毒性
ラットに対するLD50は60 mg/kg (腹腔)であり肝障害を特徴とする。また,アヒルひなに対する胆管過増殖でみるとき,その毒性の強さはアフラトキシンB1の 125分の1であると言う。ラットやマウスに長期投与すると肝癌,肺癌などを生じ,Dickens らのラット皮下注射による長期試験では肉腫が発生しており,発癌力はアフラトキシンB1の250分の1と推定されている。
汚染
ステリグマトシスチンには,多くの関連物質が発見されている。日本各地の土壌,穀類等によりA. versicolorを分離すると全国的に分布していることがわかり,またこれらの菌の大部分がステリグマトシスチンの産生能を有していた(真鍋ら,1976)。
分析方法
試料の粉砕物にアセトニトリルと4%のKClを加え,浸透した後,ろ紙で濾過する。一部をとり,ヘキサンで脱脂した後,濃縮する。少量のベンゼンで溶解し,シリカゲルのカラムにかける。サイクロヘキサン-酢酸エチル(4+1)の混液で溶出し,溶離液を濃縮し,少量のメタノール-水(65+35)で溶解し,HPLCで分析する(Stack, M. et al., 1971)。
原料あるいは食品での規制値
発がん性は認められているが,急性毒性が弱いためか,現時点では,規制値は決められていない。
危害の除去法
ステリグマトシスチン産生菌であるA. versicolorやA. nidulansが生育しないように,農産物を乾燥し保存することが,必要である。汚染されると,除去は難しい。
文献
- 真鍋 勝ら: Proc. Jap. Assoc. Mycotoxicol., 3/4, 31-35(1976).
- tack, M., Rodricks, V.: J. Assoc. Offic. Anal. Chem., 54, 86-90(1971).
オクラトキシン
由来
オクラトキシン産生菌としてAspergillus ochraceusが知られているが,この菌の名前に由来している。オクラトキシンには,オクラトキシンA,B,Cの三つが知られている。
産生菌
産生菌は,AspergillusとPenicilliumに属する多くの種類の菌が報告されているが,自然汚染を起こす主な菌はA. ochraceus とP. viridicatumである。
構造

毒性
オクラトキシンAはCに比べて,毒性が強い。オクラトキシンBは,アヒルひなに対しては毒性を示さなかった。障害は主として肝臓と腎臓に現れる。オクラトキシンAのアヒルひなに対する毒性は,アフラトキシンB1の10分の1 の強さを示した。
汚染
A. ochraceus の分布域は広く,米,麦,トウモロコシ,小豆,大豆,グリーンコーヒー,煮干などから見出されており,我が国の土壌,穀類から分離したA. ochraceus菌群の10株の内 8株にオクラトキシンの産生を認めている。我が国では,内山らにより長崎県の農家保有米から汚染が発見されている。Kroghらは,腎臓病にかかった豚の腎臓,肝臓,脂肪,筋肉と鶏の筋肉にオクラトキシンを認めている。また,Fuchsらは風土病バルカン腎症として知られる地域の人々の0.4~2.5%の血液からオクラトキシンAを検出している(Fuchs et al.,1991)。
分析方法
粉砕した試料に,アセトニトリル-1%リン酸(99:1)を加え,振盪抽出した後,ろ過する。このろ液の一部をジエチルアミノプロピルシリル化シリカゲルカラムにかける。まずアセトニトリル-アセトン(1:1),次いで80%メタノール-酢酸(99:1)を流し,カラムを洗浄する。80%メタノール-トリフルオロ酢酸(99:1)で溶出する。減圧濃縮したものに,アセトニトリル-水(40:60)を加え溶解したものを,HPLCで分析する。
原料あるいは食品での規制値
オクラトキシンAの規制値については,日本においてはまだない。しかし,ヨーロッパではある。例えば,ベビーフードおよび幼児のための食品では0.5 ppb,乾燥ブドウでは10 ppb,加工穀類および穀類製品3 ppb,生の穀類の穀粒(加工前のコメ,ソバを含む)5 ppb,コーヒーを除く焙煎コーヒー豆5 ppb,溶けるコーヒー(幼児用)10 ppb,ワイン,グレープジュース,ブドウ汁1 ppbとなっている(Akiyama, H. et al., 1997)。
危害の除去法
オクラトキシンが産生されると,その除去は難しい。オクラトキシンが産生されないよう,穀物などの農産物が収穫されると速やかに乾燥し,カビが生育しないようにすることが肝要である。
文献
- Akiyama, H. et al.: J. Food Hyg. Soc. Japan, 38, 406-411(1997).
- Fuchs, R. et al. (1991): Human Exposure to Ochratoxin A: in Mycotoxins, Endemic Nephropathy and Urinary Tract Tumors. (Castegnaro, M. et al. eds.) International Agency for Research Cancer, Lyon. pp. 131-135.
パツリン
由来
パツリンは,Penicillium patulum の代謝産物として分離されたことからこの名称が決まった。
産生菌
産生菌の種類は多く,P. expansum, P. melinii, P. claviformeやAspergillus 属のA. clavatus, A. giganteus, A. terreus の報告がある。
構造

毒性
マウスに対するLD50は,10 mg/kg (皮下注射)で,主として毛細血管の拡張と出血をきたすほかは著しい臓器障害は示さない。パツリン0.2 mg を週2回皮下に投与すると15ヶ月後に投与部分に肉腫が発生したとの報告がある。
汚染
パツリンは,リンゴの腐敗菌であるP. expansumからも大量に産生されことから,腐敗リンゴやリンゴジュースによく汚染が認められている。
分析方法
検体に酢酸エチルを加え振盪した後,酢酸エチル層を別の試験管にとる。水層に酢酸エチルを加え振盪し,酢酸エチル層を先ほどの試験管にとる.この酢酸エチル層にとる操作を2回繰り返す。酢酸エチル層に1.5%Na2CO3溶液を加え,振盪し,酢酸エチル層をとる。無水Na2SO4で脱水した後,減圧濃縮する。残留物に酢酸水溶液を加えたものを,HPLCで分析する(日本薬学会編,2005)。
原料あるいは食品での規制値
我が国においては,平成15年11月26日付けの厚生労働省告示で,「りんごの搾汁及び搾汁された果汁のみを原料とするものにあっては,パツリンの含有量が0.050 ppmを超えるものであってはならない」と規制された。
危害の除去法
パツリンも産生されると除去するのは,難しい。リンゴジュースにしばしば検出されるが,使用するリンゴがカビに汚染されていないものを使うようにすれば,パツリン汚染が軽減されることが知られている。
文献
- 日本薬学会編.(2005).:衛生試験法・注解 2005,金原出版,pp.277-278.
フザリウム・トキシン
(1)トリコテセン系マイコトキシン
トリコテセン系マイコトキシンは,数多く知られているが,トリコテセン系マイコトキシンの中で自然汚染が確認されているのは,ジアセトキシスシルペノール(DAS) ,T-2トキシン(T-2),ニバレノール(NIV),デオキシニバレノール(DON),3-アセチルーデオキシニバレノール(3-Ac-DON),15-アセチル-デオキシニバレノール(15-Ac-DON),それにフザレノン-X(Fus.-X)の7種類である。
構造
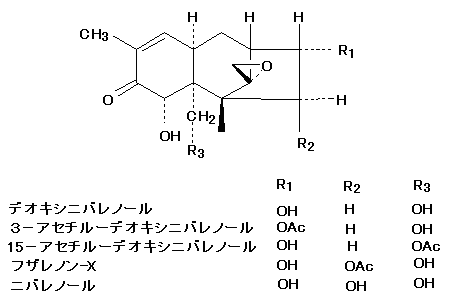
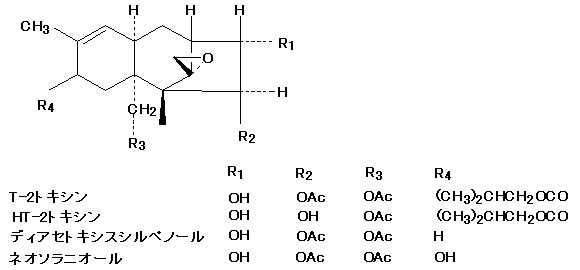
汚染
我が国では古くから麦類赤かび病菌として知られる菌が穀類汚染の主体となっており,ニバレノール(NIV),デオキシニバレノール(DON),3-アセチルーデオキシニバレノール(3-Ac-DON),15-アセチルーデオキシニバレノール(15-Ac-DON),それにフザレノン-X(Fus.-X)の自然汚染が認められている。最近T-2 トキシン(T-2)の自然汚染についても取りざたされている。
文献
- 田中健治:植物防疫,58(4),162-166(2004).
A.デオキシニバレノール
由来
菌学検査で分離されるFusarium菌種では,F. graminearumあるいはその完全世代の子のう菌Gibberella zeaeが多く,我が国では古くから麦類赤かび病菌として知られる菌が穀類汚染の主体となっている。
産生菌
Fusarium graminearumが知られている。
構造

毒性
毒性は,マウス,ラット,モルモット,ネコ,馬等で調べられているが,一般に急性毒性はかなり強いが,発がん性は認められていない。マウスに対するLD 50(i.p.)は,DONは雄マウスで70 mg/kg,雌マウスで49.4 mg/kgであった(Chelkowski, J. ,1989)。
汚染
国産小麦,外国産小麦,国産大麦それに外国産大麦いずれからも,DONおよびNIVが検出されている。また,芳澤らは,国産の小麦,大麦からDON,3-Ac-DON,15-Ac-DON,Fus.-XおよびNIVを検出している(Yoshizawa, 1997)。地理的分布では,小麦や大麦を分析した結果,日本の北部では主にDONが検出され,中部では主にNIVが検出され,南部ではDONもNIVも検出されたが,DONの量は,NIVの量に比べて四国では少なく,九州では多いという結果を得ている。
分析方法
試料を粉砕し,アセトニトリル-水(3:1)を加え振盪し,ろ過する。ろ液の一部をとり,ヘキサンで脱脂をする。アセトニトリル層を分取し,(NH4)2SO4を加えて振盪後,水層を除去する。アセトニトリル層を無水Na2SO4で脱水し,減圧濃縮する。これをHPLCで分析するか,あるいはTMS化剤でTMS誘導体にし,ECD-GCで分析する。抽出液をMulti-sep #227カラムにかけ,不純物を除き,精製する方法もある(日本薬学会編,2005,Tanaka, K. et al., 2004)。
原料あるいは食品での規制値
食品については,2003年5月に日本でも暫定基準値が出された。体重50 kgの成人が,一日当たりデオキシニバレノールを摂取する量を,1 ?g/kg体重/日に抑えるための玄麦の汚染レベルが算出され1.1 ppmとなった。また,飼料については,平成7年11月15日付け7畜B代1660号畜産局長通知により,家畜等(生後3ヶ月以上の牛を除く。)に給与される飼料に含まれることが許容されるデオキシニバレノールの最大値は1.0 ppm,生後3ヶ月以上の牛に給与される飼料に含まれることが許容されるデオキシニバレノールの最大値は4.0 ppmと決められた。
危害の除去法
一度産生されると,除去するのは難しい。ムギの開花の時期に,汚染の原因となるF. graminaerumなどの菌株の感染を抑えるような方策が必要である。赤かび病抵抗性の品種(田中健治ら,2003)や農薬の種類,散布時期などの研究が行われている。ムギ類を食品加工する段階でトリコテセン系マイコトキシンがどのように推移するかを検討し,非可食部に80%以上が残ることが明らかになった(Tanaka, K. et al.,1999)。
文献
- Chelkowski, J.: Topics in Secondary Metabolite-Volume 2, Fusarium Mycotoxins, Taxonomy and Pathogenicity, Elsevier, Amsterdam-Oxford-New York-Tokyo,1989)
- 日本薬学会編.(2005).:衛生試験法・注解 2005,金原出版,pp.270-276.
- Tanaka, K. et al. (1999): Proc. Int. Symp. Mycotoxicology ’99 – Mycotoxin contamination: Health risk and prevention project. 95-100.
- 田中健治ら:日植病報,69, 282-283(2003).
- Tanaka, K. et al.: J. Food Hyg. Soc. Japan, 45(2), 63-66(2004).
- Yoshizawa, T: Bull. Inst. Comp. Agr. Sci. Kinki Univ., 5, 23-30(1997).
(2)ゼアラレノン
由来
投与飼料によってブタが外陰部肥大などのエストロジェン(未発育の哺乳動物に発情させる女性発情ホルモン物質)様症状を引き起こした例が,1928年のアメリカにおける飼料用トウモロコシを始めとして報告が多数ある。Stobらによって,またUrryらによって毒性物質が化学的に明らかにされ,ゼアラレノンと名付けられた(Urry, W.H. et al., 1966)。
産生菌
Fusarium graminearum, F. culmorum, F.tricinctumが知られている。
構造
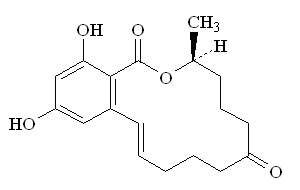
毒性
子宮肥大などのいわゆるエストロジェン様の作用を示す。
汚染
穀類の汚染例が多く,しばしばトリコテセン系マイコトキシンとの複合汚染が認められる。
分析方法
試料に水を加え潤した後,クロロホルムを加え振盪する。遠心し,下層のクロロホルムをとり,無水のNa2SO4を加え脱水する。ろ過し,ろ液を減圧濃縮する。濃縮物にトルエンを加えて溶解し,SEP-PAK SILICA CARTRIDGEで精製する。精製物はメタノールに溶解し,HPLCで分析する(飼料分析基準研究会編,1998)。
原料あるいは食品での規制値
食品については,日本においては規制値はまだない。ヨーロッパでは,下記のようになっている。パン,ペーストリー,ビスケットでは50 ppb,トウモロコシの粉を除く穀類粉75 ppb,トウモロコシの粉/ミール/グリッツ/精製していないトウモロコシオイルで200 ppb,トウモロコシのスナック/トウモロコシが主体の朝食用穀類で50 ppb,幼児や若い子供用の加工した穀類が主体の食品で20 ppb,トウモロコシ以外の加工していない穀類で100 ppb,加工していないトウモロコシで200 ppb。飼料については,平成7年11月15日付け7畜B第1660号畜産局長通知により,家畜に給与される飼料に含まれることが許容されるゼアラレノンの最大値は,1.0 ppmと決められた。
危害の除去法
一度産生されると除去は難しい。Fusarium属菌がムギやトウモロコシなどに感染するのを抑える必要がある。
文献
- 飼料分析基準研究会編.(1998).:飼料分析基準注解(第3版),日本科学飼料協会,pp.89-93.
- Urry, W.H. et al.: Tetrahedron Lett., 7, 3109-3114(1966).
(3)フモニシン
由来
フモニシンは,1988年に南アフリカでウマの白質脳症の原因物質として発見されたマイコトキシンである。ウマの白質脳症の原因菌としてFusarium moniliforme(現在F. verticillioides)が検討され,その原因物質が本菌の産生するフモニシンであることが判明した。
産生菌
産生する菌としてはF. moniliformeやF. proliferatumが多いが,Alternaria alternataが産生するという報告もあり,産生菌は広く分布しているようである。
構造
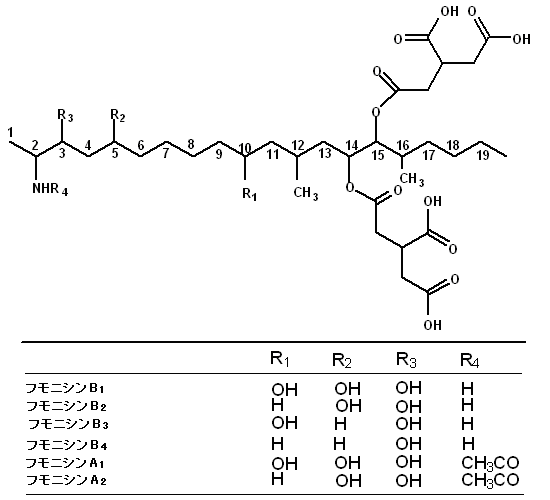
毒性
ウマの白質脳症の原因物質として単離された。フモニシンと食道癌との関連性もとりざたされている。癌との関係では,癌のプロモーターの役割があると当初いわれたが,発癌性もあるようである(Howard et al., 1999)。フモニシンを,ブタやウマに毒性を示す程度の濃度になるよう飼料中に混ぜてウシを飼育させた実験結果があるが,高濃度(148μg/g)にすると影響が出るが,ウシは一般的にはブタやウマに比べて感受性は低いようである(Osweiler et al.,1993)。
汚染
フモニシンの農作物への汚染状態を調べたものとしては,Thielらのウマの白質脳症やヒトの胃癌の発生との関連性を調べた飼料中のフモニシン量の調査がある(Thiel et al.,1992)。高濃度汚染地域では,トウモロコシ中のフモニシン濃度が122 ppmという値を示す場合があった。国産のムギからも検出されている(Trucksess, M.W.,2000)。
分析方法
サンプルを75%メタノールで抽出し,Varian社製の固相抽出カートリッジ(Bond Elut SAX)で精製する。抽出物を蛍光誘導体化し,HPLC-蛍光検出し,定量する。
原料あるいは食品での規制値
国産農産物の規制値はない。ヨーロッパでは,下記のようになっている。人が食べるトウモロコシが主体の食品で400 ppb,トウモロコシのグリッツと粉で1,000 ppb,幼児および若い子供用の加工したトウモロコシが主体の食品で200 ppb,未加工のトウモロコシで2,000 ppb。
危害の除去法
汚染されると除去は困難である。汚染されないようにする必要がある。汚染したフモニシンをアンモニアによって処理することにより,フモニシンそのものは減少しても,ラットに対する毒性はそれほど減少しないという報告がある(Norred et al.,1991,Voss et al.,1992)。また,エタノール発酵ではフモニシンはあまりこわれないともいわれている(Bothast et al.,1992)。
文献
- Bothast R. J. et al.: Appl. Environ. Microbiol., 58, 233-236(1992).
- Chen J. et al.: Appl. Environ. Microbiol.,58, 3928-3931(1992).
- Howard, P.C. et al. (1999): Mycotoxins Supplement ’99, Proc. Int. Symp. Mycotoxicology ’99 – Mycotoxin contamination: Health risk and prevention project,Chiba. pp. 45-54.
- Nelson, P. E. et al.: Appl. Environ. Microbiol., 58, 984-989(1992).
- Norred, W. P. et al.: Food Chem. Toxicol., 29, 815-819(1991).
- Osweiler, G. D. et al.: J. Anim. Sci., 71, 459-466(1993).
- Thiel, P. G. et al.: Appl. Environ. Microbiol., 57,1089-1093(1991).
- Thiel, P. G. et al.: Mycopathologia, 117, 3-9(1992).
- Trucksess, M.W.: in Official Methods of Analysis of AOAC INTERNATIONAL, Horwitz, W. ed., AOAC INTERNATIONAL, Chapter 49, (2000).
- Voss, K. A. et al., Mycopathologia, 117, 97-104(1992).