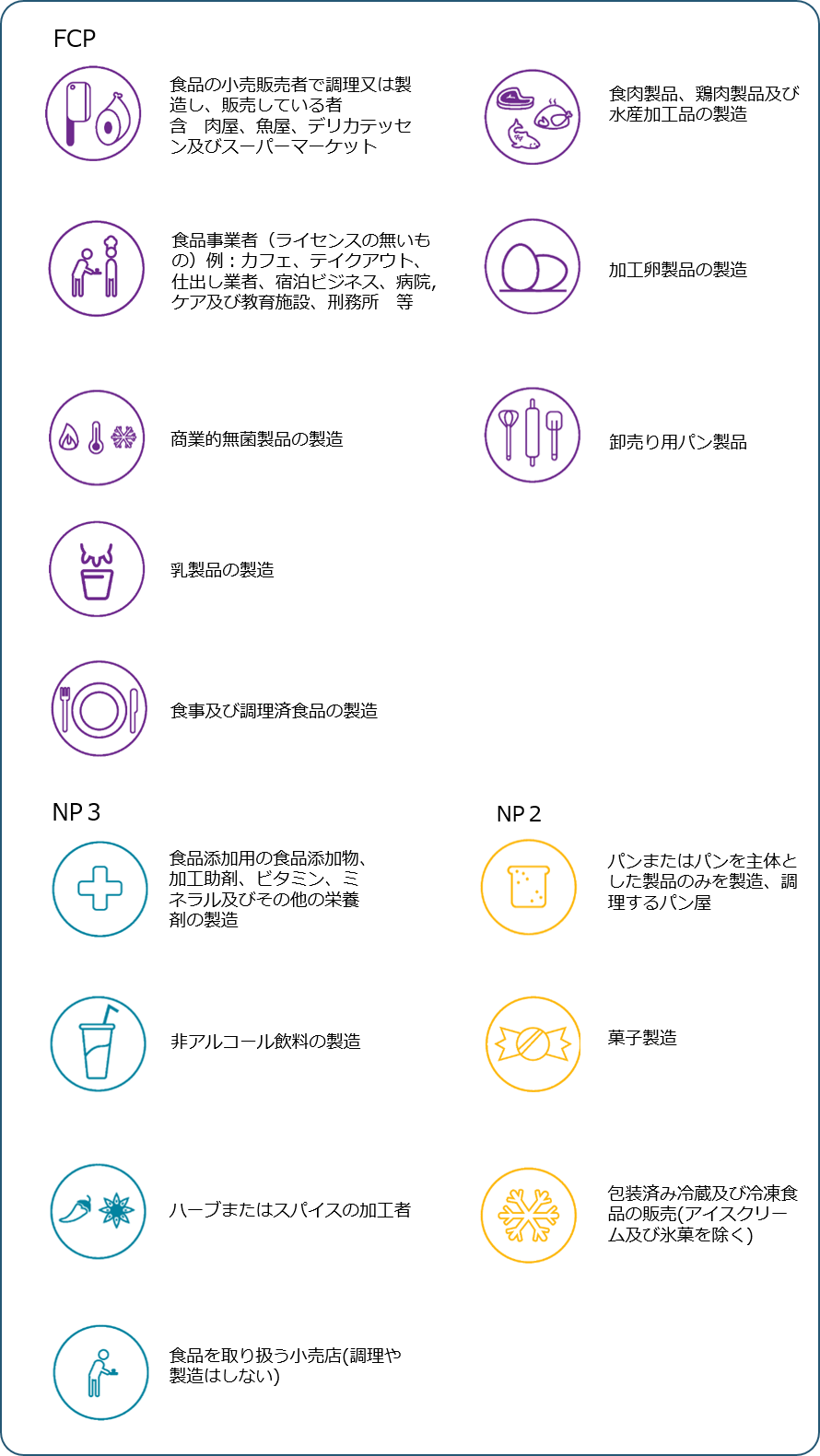
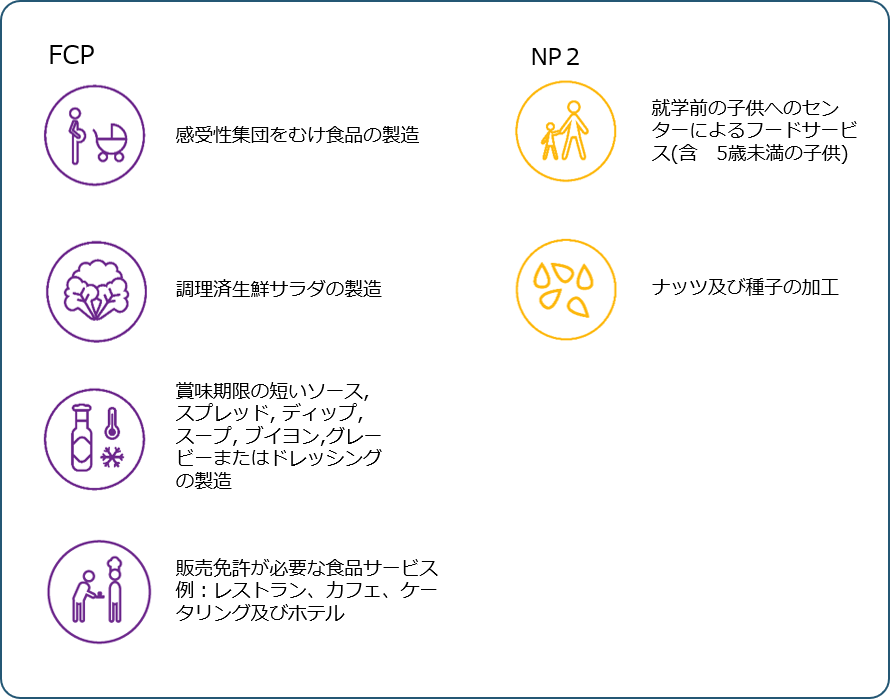
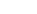化学的・物理的危害要因情報
化学的危害要因
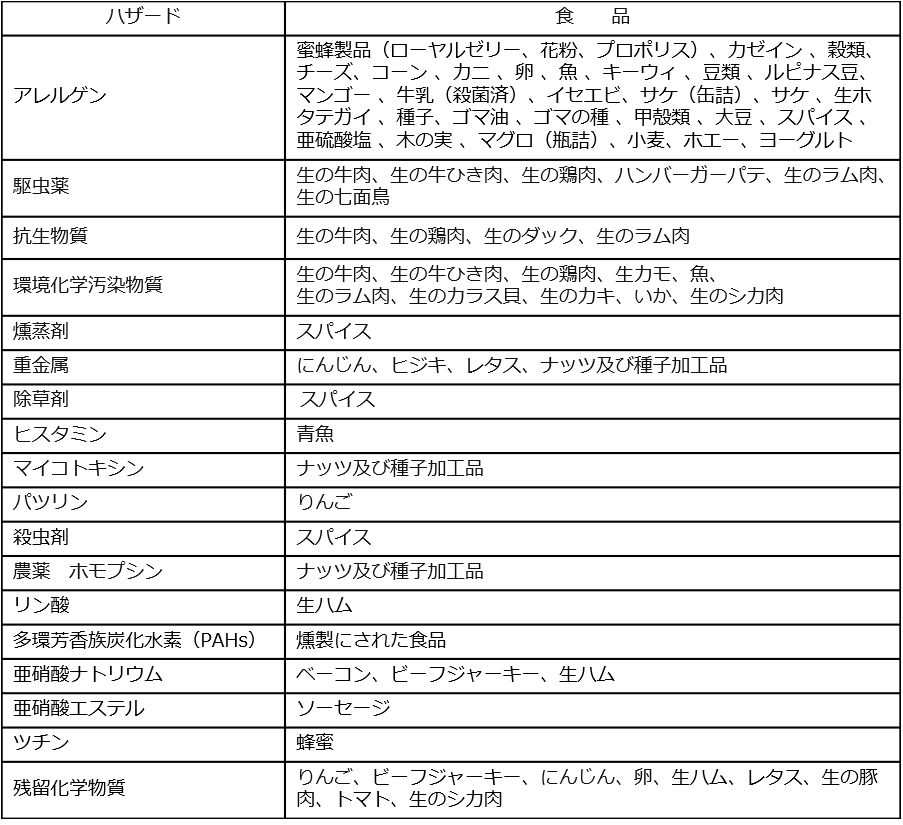
重金属
1. 金属
人類の生活と金属は古くから関わりがある。古代ローマではブドウジュースを煮詰めるために鉛の鍋を使用していた。また、ワインを鉛の内張りの青銅器で温めて飲んでいたため、鉛毒性痛風など鉛中毒が多発し、これがローマ帝国滅亡の原因であったと言われている。
一般に、食品の中には微量の金属が存在している。銅や亜鉛のように必須元素ではあるものや、限度を超して摂取すると、食中毒の原因となるものなどがある。また、ヒ素や鉛、カドミウムのように毒性が強く蓄積性のあるものは、食品衛生法に規格が定められている。それらについては食品、あるいは食品原料とする場合、留意する必要がある。
食品衛生法で何らかの記載のある元素は次の10元素である。
また、銅および亜鉛は必須元素であるが、大量に摂取することにより食中毒を起こした事例も見られる。
2. 金属の毒性
食品の安全性に関係のある金属の多くは重金属であるが、ヒ素は毒性が強いが軽金属であるため、一般にはヒ素及び有害性重金属と表現される。
食品中の有害性重金属は鉛、カドミウム、銅、亜鉛、スズなどが食品衛生法の対象となる。これらは金属の種類によって異なるが、原料に混入する可能性があるものや容器から食品中に移行する可能性があるものなど様々である。
食品衛生法で記載されているヒ素及び有害性重金属について掲載した。
3. 分析法
金属の分析法はいずれも灰化後原子吸光光度法、またはICP、ICP/Msなどで測定する。
亜鉛(zinc) Zn
来 歴
金属亜鉛は、中世時代にインドや中国で製造された。ヨーロッパで金属亜鉛の抽出や製造が始まったのは1700年中ごろである。
亜鉛は25番目に多い元素で、自然界に広く分布している。動植物の必須微量元素である。
最も多く存在し、かつ重要な鉱石は、硫化物(閃亜鉛鉱ZnS)、炭酸塩(菱亜鉛鉱)、ケイ酸塩(カラミンや異極鉱)、マグネシウムと鉄との混合化合物(フランクリン石)である。動植物にも広く分布している。
亜鉛の最も重要な用途は、鉄や鋼を腐食から守るため亜鉛やカドミウムの被膜を作る亜鉛めっき(トタン)である。また、亜鉛化合物の用途としては、酸化亜鉛がゴムタイヤの補強剤、白色顔料、ステアリン酸亜鉛はゴム産業で粉付けゴム、硫化亜鉛は蛍光灯、ブラウン管などに使用する。
欠乏症
亜鉛が欠乏すると食欲減退、成長阻害、性器発育不全、角化症,神経精神症状,食欲低下,味覚・臭覚不全,ビタミンA欠乏症,脱毛などの症状が現れる。亜鉛は亜鉛含有酵素であるアルカリフォスファターゼ,カルボキシペプチダーゼ,炭酸脱水酵素,アルコール脱水素酵素などの成分であり、亜鉛が欠乏するとこれらの酵素活性が低下する。またインスリンや脳下垂体ホルモンの合成,分泌,標的器官結合、機能に影響を及ぼし、逆にホルモンは亜鉛の代謝に影響を及ぼす。
亜鉛の特徴は,遊離型で体内貯蔵量が極めて少ないことであり,食餌からの摂取が止まると24時間以内に,血清中の濃度は欠乏時の範囲に低下する。この場合でも組織内の亜鉛濃度は一定期間正常値に保たれ、亜鉛と結合性の強いタンパクが組織中に多量に存在することが予想される.また亜鉛の吸収は,摂取する化学形によって大きく左右される.
穀類中のフィチン酸によって亜鉛の吸収が阻害され,欠乏症の生じた例もある
食品中の亜鉛含量は動植物が生育する環境(水,土壌,大気)の影響を受けやすく,人工的にも栽培・生産(肥料,飼料組成)件によって異なる。さらに食品の部位,食品の加工調理過程の影響が大きく,亜鉛含量もこれらの要因により変動する。
中毒症状・毒性
職業上曝露による急性中毒では、生成直後の亜鉛ヒュームを吸入することで起きる金属ヒューム熱がもっとも重要である。メッキされた鉄鋼の溶接に従事し、金属製煙霧にさらされてから3~10時間以内に風邪に似た症状(頭痛・寒気・倦怠感・疲労感・筋肉痛・発熱・発刊・咳) が現れる。通常24~48時間で回復する。
また、亜鉛メッキの容器で酸性の液体を飲んだときの、嘔吐を含む消化器系症状なども起こることがある。
慢性経口摂取では、鉄芽球性貧血が知られている。メカニズムとしては、過剰な亜鉛による、腸管からの銅吸収障害で銅欠乏が生じ、オキシダーゼ活性を有するセルロプラスミンの低下や銅酵素であるチトクロムオキシダーゼの活性低下による鉄再利用の阻害と考えられる。
慢性中毒の有無に関しては一定の見解がない。
代謝
ヒトにおける生体内の全亜鉛量は、約2gといわれ、絶対量としては骨格筋(50~60%)、骨(28%)、肝に多く、濃度としては前立腺、肝が高い。
亜鉛の吸収は十二指腸から小腸にかけて行われ、受動的拡散とエネルギー依存性の単体輸送の2つの経路がある。食物からの吸収率は20 ~30 %である。
排泄経路は、主として膵臓からであり、1日に2~5mgが膵液とともに腸管内に分泌される。尿中へは、1日に500~800μgが排泄されている。汗中へは、尿中とほぼ同量の亜鉛が排泄される。この他、腸上皮細胞の新陳代謝や、皮質角化層の脱落、爪・毛髪への移行等による排泄経路があげられる。
規格
飲食物における亜鉛の規格試験としては,食品添加物の強化剤としてグルタミン酸亜鉛と硫酸亜鉛がある。母乳代替え食品(調製粉乳)が対象となっており,使用基準は標準調乳濃度で亜鉛として6mg/g以下である。なお,調製粉乳の加工技術の高度化とともに原料ミルク中に存在する亜鉛が脱塩などの加工工程で減少し、乳児の必要量を満たせなくなってきたので、これらの添加物の使用が認められた(昭和58年8月27日環食化第38号)。
1日摂取推奨値:15mg/日
食品衛生上の注意点
亜鉛は人体にとって必須の金属であり,70kgの男子の場合には総量1.4~2.3gを保持しており、必要量は成人で15μg/日である。成長期や妊娠時には,その要求量が40mg/日とされている。
亜鉛はグルコン酸亜鉛、硫酸亜鉛調製粉乳に食品添加物として強化されているが、無機亜鉛を大量に摂取すると、食中毒症状を呈する。
食中毒事例
昭和27年7月 金沢市において「乳飲料」を飲んで22名が中毒した。症状は腹痛、嘔吐、下痢を呈した。原因は乳飲料を亜鉛引バケツに入れたために亜鉛が過量に溶出したことによる。
含有量
主要食品中で亜鉛含量の多いものは、牛肉50~80μg/g、豚肉20~50μg/g、鶏肉5~30μg/g、魚肉3~15μg/g、カキ140~270μg/g、大豆40~50μg/g、インゲン豆20~60μg/g、である。野菜や果物などの植物性食品中の亜鉛含量は動植性食品に比べて一般的に少なく、野菜類1~10μg/g、果物類0.5~2μg/gである。なお、野菜類では,果菜類に比べて葉菜類と根菜類が多く、主に緑色部に多い。
アンチモン(antimony)Sb
来 歴
アンチモンおよびアンチモン化合物の使用は、少なくとも紀元前4000年前には始まっている。アンチモンの鉱石鉱物として輝安石と方安鉱がもっとも重要で、これらはしばしば鉛・銀・銅の鉱床に伴って産出する。主要産出国はボリビア、南ア連邦、中国、フランス、メキシコである。
アンチモンの冶金における用途としては合金成分が重要である。アンチモンは鉛やその他の金属の硬度を増大させる。アンチモン鉛は鉛蓄電池の電極格子、高純度アンチモンは半導体材料、硫化アンチモン(Ⅲ)は花火やある種のマッチ、顔料、ルビーガラスの材料に、酸化アンチモン(Ⅲ)は布の難燃剤、ガラスや陶磁器、ほうろう等に用いられる。
中毒症状・毒性
アンチモンは、細胞内の酵素や補助因子と反応することで毒性を発現する。
急性アンチモン中毒の毒性は、著しい体重の減少、脱毛、皮膚の乾燥、鱗片状の皮膚である。また、血液学的所見では好酸球の増加が、病理的所見では心臓、肝臓、腎臓に急性のうっ血が認められる。
古い磁性の容器を使用したことによる中毒事故も報告されている。これは、容器内の飲料物が酸性で、アンチモンを容器から溶出させてしまったためとされている。症状は胃の灼熱感、せん痛、吐き気、嘔吐で3時間から数日の範囲で症状は回復する。
また、鉱山や溶鉱炉でアンチモン化合物を取り扱っている作業員に関して、アンチモン皮疹という皮膚に対するアンチモンの作用がある。アンチモン皮疹は、汗腺や脂腺の周りにできる丘疹や膿庖からなる発疹で、みずぼうそうの膿庖に似ている。前腕や大腿、衣服が曲がったり擦れたりする場所にでき、気温の高いとこで起こりやすい。
塩化アンチモン(Ⅲ)、あるいは5価のアンチモン化合物を吸入した場合は、慢性鼻炎や肺水腫になるおそれがあり、長期暴露の場合は、気管支炎、閉塞性肺疾患を引き起こす恐れがある。
また、硫化アンチモンの曝露によって、心臓障害が起こる。アンチモンを取り扱う工場の女性従業員が、曝露されていない女性に比べ自然流産しやすいという報告もある。アンチモンのエーロゾルに曝露された女性冶金従業員の間に、後期自然流産(対照群4.1%に対し12.5%)、早産(対照群1.2%に対し3.4%)、婦人科的な問題(対照群56%に対し77.5%)が高い割合で起こっている。生後3ヶ月目に、対照群の乳児に比べて成長の遅れ(体重)が出始め、1歳では有意となった。
水素化アンチモンは、無色の不快な臭気を有する有毒な気体である。人の急性中毒の徴候は、頭痛、吐き気、脱力感、呼吸数の減少、弱くて不規則な脈拍である。
代 謝
アンチモンは消化管からかなりゆっくりと吸収され、アンチモン化合物の多くは消化管を刺激する。血液では3価のアンチモンは赤血球に多く、5価のアンチモンは血漿中に多い。アンチモンの排泄は3価5価ともに尿中と糞便からなされるが、3価は尿中に、5価は糞便に多く排出される。3価アンチモンは肝臓や赤血球との親和性が強い。しかし繰り返し投与した場合には、赤血球中の濃度とは無関係に肝臓に蓄積する。
食品衛生上の注意点
ポリエチレンフタレート(PET)、4%酢酸で60℃、30分で溶出は0.05μg/mL以下の規格がある。
現在のところ食品衛生上の問題はない。
食中毒事例
アンチモンによる食中毒例は見当たらない。
カドミウム(cadmium)Cd
来 歴
カドミウムは1817年、酸化亜鉛の不純物としてドイツの鉱物学者F.Strohmeyerによって発見された。
カドミウムは天然に遊離状態で産出することはなく、ほとんど亜鉛に伴って産出する。
カドミウムの約75%は、鉄や鋼など腐食されやすい金属をめっきするのに使われる。また、原子炉の制御棒・遮蔽剤にも使われ、Ni-Cd電池向けの消費も増加している。その他、美術用顔料、自動車工業用塗料、塩化ビニル安定剤、ブラウン管用発光体に用いられる。
中毒症状・毒性
Cdヒューム吸入による急性影響は、吸入数時間後から生じる咽頭痛、咳、悪寒、息切れ、呼吸困難、筋肉痛、発熱、肺水腫、間質性肺炎である。
慢性影響は、閉塞性肺疾患、肺気腫および腎機能障害が主な症状である。腎機能障害として特に近位尿細管機能異常が知られている。
また、Cd汚染地域に住む閉経後女性に「イタイイタイ病」といい、骨軟化症、骨粗しょう症といった骨疾患が多発した。このような骨疾患は、カドミウムがカルシウム代謝に影響しているためと考えられている。
代 謝
経気道的に吸入されたカドミウムの吸収率は、カドミウムの溶解性やヒューム粒径により異なるが10~60%である。
カドミウムの腸管吸収は、まず腸粘膜から吸収され、吸収されたカドミウムの大半が腸粘膜内でメタロチオネインと結合し、Cdメタロチオネインとして肝臓、腎臓に蓄積され、特に腎皮質に高濃度に蓄積される。
カドミウムの生物学的半減期はヒトで18~33年と推定されている。
食品衛生上の注意点
穀類、米(玄米)にカドミウム及びその化合物:1.0ppm未満(cdとして)、その他、容器もしくは容器包装又はこれらの材質別規格にカドミウムの規格がある。ほ乳器具等のゴムにはカドミウムに関する規格がある。
清涼飲料水、粉末清涼飲料にカドミウムは検出されてはならないとの成分規格がある。
食中毒事例
昭和41年東京都で患者数は300名、吐き気、嘔吐を主症状とする事例が起きた。原因は麺を入れて加工する金属バスケットの一部にカドミウムメッキが施してあり、そのカドミウムがうどんに移行したためと判断された。発症は短いもので約30分、大多数は1~2時間であった。
スズ(tin)Sn
来 歴
スズは古代から人類に利用されている金属のひとつである。空気中、水中で腐食されず、展延性に富み、かつ他の金属と合金を造りやすい性質があることからその用途は広い。銅との合金である青銅は5000年以上の歴史を持つ。
スズは地殻中に0.001%と比較的微量である。主鉱石は天然の酸化スズ(Ⅳ)であるスズ石が重要である。
スズの主要産出国はマレーシア、インドネシア、ボリビア、タイ、ロシア、中国、ブラジルである。またアメリカではスズの再利用を進めている。
主な用途は、無機スズでは活字用合金、軸受用合金、錫箔、スズ器、鋳造用ブリタニアメタル、歯科用アマルガム、ガラスの強化、触媒、タイルやセラミック製品の顔料としても使われる。有機スズは、1950年代以降に合成が盛んとなり用途も増した。触媒、殺生物剤などがある。
缶詰のメッキとして使用されている。スズによるメッキはを施されたものは白缶といわれる。白缶は果実缶詰などに主として使用されているが、その還元力により、褐変を防ぐ、特にビタミンCの分解を防ぐなどの理由で使用される。
中毒症状・毒性
無機スズ化合物の急性中毒は、缶ジュースや缶詰フルーツに高濃度のスズが含まれていたことによる症例が世界各地にある。主な症状と徴候は、吐き気、嘔吐、下痢、疲労感および頭痛である。缶詰中の食品が高濃度のスズを含む原因の多くは、硝酸肥料を施した土壌で生育された作物が高濃度の硝酸根を含有したり、何らかの理由で缶のメッキが腐食されたことによる。
有機スズ化合物は、一般式RnSnX4-nで示されるが、Rの種類と数により毒性は大きく異なる。そして無機スズ化合物よりはるかに強い。トリアルキルスズ、中でもトリメチルおよびトリエチル化合物の毒性が強い。トリ体は脳血管関門を通過するので中枢神経系の障害、脳浮腫の原因となることがある。トリ体の中毒症状としては四肢の脱力・麻痺、全身の振戦などである。経皮、吸入曝露ともに重症例では激しい頭痛、強い嘔吐、心窩部痛を訴え失神状態に至る。モノ体の毒性は、ジ体およびトリ体に比べ低毒性である。ジ体は皮膚、粘膜に対して刺激作用がある。テトラ体では一般にトリ体類似の作用があるが、これは生体内で脱アルキルされ、トリ体の型になるためと考えられている。
有機スズ化合物の慢性中毒では、ブチルスズ化合物製造従事者が、曝露16ヶ月目に味覚の減退を訴え、その後8ヶ月間症状は進行した。その他の症状は後頭部の頭痛、鼻血、倦怠感、肩こりなどである。
代 謝
無機、有機スズともに経口摂取では腸管吸収率は低く、無機スズは胆汁へ排泄され糞便として体外へ、有機スズでは糞便中へ直接排泄される。また尿中からも排泄される。
食品衛生上の注意点
食品衛生法によるスズの規格は150.0ppm以下である。スズは白缶の内面塗装に使用されているが、現在の缶にはスズが一定以上溶出しないように工夫されており、購入後に開缶後、そのまま冷蔵庫等に保存すると急激にスズが溶出する。したがって、開缶後に保存する場合には、内容物を綺麗なガラスの容器に保存することが必要である。
食中毒事例
トマトジュース缶詰による中毒、柑橘ジュースによる食中毒が発生したことがある。これらはいづれも亜硝酸によるものであった。
前者は未熟の原料を使用したことによる。後者は地下水の中に亜硝酸イオンが入っていたことによる。
この事件を契機に食品、特に缶詰に使用する地下水についてはイオン交換処理をおこなうようになった。
セレン(selen)Se
来 歴
1817年に発見された。天然には重金属の硫化鉱中に存在する。
セレンはさまざまな生理活性を有する必須微量元素である。セレン中毒は、セレンの生理機能や必須性が明らかになる前の1930年代に、特に家畜で問題とされてきたが、比較的最近でもヒトや野生生物のセレン中毒が報告されている。
中毒症状・毒性
土壌中に高濃度のセレンが存在する地域では、セレン蓄積植物が100~10,000ppmものセレンを蓄積する。米国で起きていた家畜類の病気が、これらの植物を食べることによっておきるセレン中毒であることが1930年代になって明らかになった。このセレン中毒は症状によって以下の3つに分類できる。
急性毒性
10,000 ppmものセレンを含有する植物を食べた場合に呼吸困難、歩行異常、姿勢異常、衰弱、下痢を呈する。数時間で死亡することもある。普段、家畜はこのような植物を避ける習性があるので急性中毒は起こりにくいが、牧草不足等でこれらの植物を食べたときに起こる。
回旋病、暈倒病
ある量のセレンを数週間~数ヶ月の間に摂取した場合に起きる。よろよろと歩き回る、食欲不振、視覚障害、前肢の衰え、呼吸障害、舌・咽頭の麻痺、肝壊死、腎炎等を伴い最後には死亡する。
アルカリ病
5~40mg Se/kgの穀類を数週間から数ヶ月に渡って摂取した場合に発症する。食欲不振、関節のびらんによる脚の不自由、蹄の変形と脱落。脱毛、痩せ衰え、貧血、肝硬変、心臓萎縮が認められる。鶏や七面鳥では、卵産生の遅れ、胚の変形、孵化率の低下が認められる。繁殖力の低下は、豚や羊などでも認められる。
ヒトのセレン中毒については、多量のセレン摂取に起因する可能性が考えられる健康障害の事例はいくつかあるが、セレン中毒であることが証明された事例は少ない。しかし、さまざまな状況証拠から、毛や爪の脆弱化、脱毛、爪の変形と脱落、慢性皮膚炎などはセレンの中毒症状であろうと考えられる。
代 謝
亜セレン酸、セレノシスチン、セレノメチオニンの腸管吸収率は高く、ラットではいずれも80%以上である。多量に投与されたセレンは肝、腎に多く分布し、セレン化合物や投与経路の違いの影響をあまり受けない。排泄も速く、多量の亜セレン酸を投与された場合には、肝のセレンは24時間後には大部分が排泄される。主要な排泄経路は、尿中にトリメチルセレノニウムイオンの形で、さらに投与量が増加すると呼気中にジメチルセレンの形で排泄され、これがセレンの過剰摂取時に認められる呼気のニンニク臭の原因であると考えられている。
食品衛生上の注意点
現在の所、食中毒等での問題点は特にない。
食中毒事例
特に見当たらない。
銅(copper)Cu
来 歴
銅は、人類が最も古くから使用していた金属の一種で、工業的にも鉄に次いで重要な金属である。銀や金といった貴金属同様、遊離した金属状態(自然銅)で天然に産出し、また道具を作るのに利用できたため、紀元前5000年以前から使われている。
銅は地殻中に70ppm、海水に0.02~0.01ppm存在する。自然銅としても産出するが、今日使われている銅の約85%は、銅を2%あるいはそれ以下含有する低品位鉱を製錬したものである。
スズと銅からなる青銅は、人類が最古に使用した合金のひとつである。銅と亜鉛が主成分である黄銅も非常に有用な合金である。
医療面では、硫酸銅が催吐剤として、また銅が子宮内避妊器具(IUD)の成分に用いられている。
中毒症状・毒性
自殺目的で大量の銅塩を摂取した場合や銅製の容器、湯沸かし器から溶出した銅が混入した飲食物を摂取した場合には、急性の銅中毒が起こる。症状は嘔吐、上腹部の痛み、下痢を伴う胃腸障害のほか、肝障害、黄疸、溶血などが観察される。嘔吐や上腹部の痛みは10~15mg程度の量で起こるとされているが、催吐性を目的とした投与量は25~75mg程度である。産業現場において経気道的に曝露した場合は、金属熱が起こる。
また、ウイルソン病という常染色体劣性遺伝疾患があり、これはセルロプラスミンが生涯にわたって欠乏し、肝に過剰に蓄積するものである。
代 謝
ヒトでは、食物から摂取した銅のうち吸収されるのは約半分で、残りは糞便として排泄される。経口摂取された場合の銅の吸収率は、少量投与の場合56%だが、多量投与(100mg)の場合は30%と投与量が多いほど低下する。
銅の吸収には2つのステップがある。第一は銅の粘膜細胞への取り込みであり、第二は輸送ステップで、粘膜細胞から血漿への移行である。
吸収された銅は直ちに血漿中でアルブミン、赤血球と結合し、大部分は肝に運ばれる。またごく微量が骨・赤血球・その他の組織に運ばれる。
銅は、肝細胞において、メタロチオネインやセルロプラスミンと結合している。
銅は主に脳と肝、心臓、筋肉、腎臓などに蓄えられている。血中でも組織中でも銅は蛋白と結合しており、多くは酵素の構成要素となっている。
銅の排泄は主に胆汁を通して行われる。尿を通しての排泄が少ない理由は、血液中の銅はセルロプラスミンをはじめ高分子たんぱく質に結合しているため糸球体でろ過されず、再吸収されてしまうためである。
食品衛生上の注意点
栄養強化剤としてグルコン酸銅、硫酸銅が調製粉乳に使用することが認められているが、一度に大量の銅を摂取すると、中毒を発症する。
食中毒事例
昭和25年6月 大阪市において179名が嘔吐、けん怠、悪心などの症状を呈する食中毒があり、原因は「ビン詰グリンピース」中に硫酸銅が533g/Kg混入されていたためであった。
鉛(lead)Pb
来 歴
鉛は、採鉱、精錬、成型が簡単であるため、古代から用いられてきた。ローマ時代には、水道管、陶器用釈薬、化粧品、鍋などに使用された。このため鉛中毒が多発し、ローマ文明は衰退したとも言われている。欧米では、家屋の内外壁の塗装に用いられた鉛含有ペンキによって鉛中毒が起きている。また日本では、母親の使用した含鉛白粉を授乳時に乳児が経口摂取したために発生した鉛脳膜炎が報告されているが、1935年に含鉛白粉が禁止されて以来、日本では発生していない。
現在、金属鉛は自動車用蓄電池の極板に最も多く用いられている。
鉛は世界中の多数の鉱石の中に広く存在するが、単体としてではなく、ふつう硫化物の方鉛鉱として存在する。鉛鉱石は一般に銀や亜鉛とともに天然に存在する。
中毒症状・毒性
急性中毒は、鉛の短時間大量曝露によって起きるがまれである。初期症状として口腔内の収斂、口渇、金属味がみられ、その後悪心、腹痛、嘔吐が続く。塩化鉛を摂食したときの嘔吐物はミルク状であり、鉛の硫化物摂取では糞便が黒色になる。大量の鉛が急激に吸収されたときには、胃腸管内への体液損失によるショック状態が見られることがある。急性の中枢神経症状としては感覚異常症,疼痛そして筋力低下があげられる。急性重症溶血のため貧血やヘモグロビン尿が認められる。また腎臓障害の結果、尿量は減少する。大量曝露後には、1~2日後に急死する例もある。この急性期を過ぎると身体に吸収沈着した鉛による慢性症状が現れる。
典型的慢性症状としては鉛蒼白、貧血、鉛縁、鉛仙痛(、鉛による伸筋麻痺、好塩基性斑点赤血球、コプロポルフィリン尿が上げられていたが、現在ではこのような症例をみることはあまりない。
鉛は胃腸管の平滑筋に作用し、消化管症状を呈する。その結果、食欲不振、腹部不快感そして頭痛があげられる。腸管の痙攣性収縮による痛みが鉛仙痛といわれるが、この鉛仙痛はしばしば便秘症状を伴う。
鉛の特徴的末梢神経症状として、神経筋症状や手首の伸筋麻痺(鉛麻痺)による下垂手がある。
中枢神経症状としては鉛脳症が重要であり痙攣や昏睡が見られ、病理的には脳の浮腫、血管の拡張や腫脹等が見られる。鉛脳症はしばしば後遺症を残すといわれており、急性鉛脳症を呈した小児患者にCa-EDTAなどによるキレート剤治療を行ったとき40%に神経学的後遺症がみられる。
鉛による血液学的影響は、①溶血性貧血と、②ヘム合成系への障害に大別される。
代 謝
無機鉛は、人の呼吸器や消化管から吸収される。吸収率を見ると、成人では呼吸器から約40%、消化器からは約10%以下であるが小児においては、消化管からの吸収は約50%に達する。吸収された鉛は血液中から肝、腎、筋肉等の軟部組織に取り込まれ、さらに安定蓄積部位としての骨組織に沈着する。鉛は脳血管関門を通過するので、脳血管関門の未熟な小児においては鉛脳症の注意が必要である。また鉛は胎盤を通過する。胎児への鉛の移行は妊娠12~24週で明らかとなり、それ以降鉛濃度は高くなるという。
鉛の排泄は一般に遅く、ヒトにおける鉛の生物学的半減期は約10年といわれており、主に腎と消化管から排泄される。消化管への排泄は、唾液腺、膵臓、そして消化管内腔に位置する分泌腺からの能動的あるいは受動的分泌、上皮細胞の脱落、および胆汁分泌による。
食品衛生上の注意点
特に食品用容器を輸出する場合、諸外国の鉛の基準値には特に注意する必要がある。
ヒ素(arsenic) As
来 歴
ヒ素は、自然環境中や生物体に広く存在するが、天然に単体として存在することは少なく、鶏冠石As4S4、石黄As2S3、硫ヒ鉄鉱FeAsSなど硫化鉱物として存在することが多い。ヒ素の原料である三酸化ヒ素(As2O3)はこれらのヒ鉱の焙焼や銅製錬工程で排出するガスの副産物として得られる。ヒ素には、無機ヒ素化合物、有機ヒ素化合物、揮発性のアルシンガスの形態がある。
ヒ素は三酸化ヒ素として世界で年間5 ~5.3万トン使用されている。その主要用途は無機ヒ素系農薬と工業薬品の原料で全体の90%以上を占め、亜ヒ酸ナトリウム、ヒ酸、ヒ酸鉛、ヒ酸カルシウムなどが木材防腐剤、殺虫剤、乾燥剤として用いられている。シューレグリーン(亜ヒ酸銅)、パリスグリーン(アセト亜ヒ酸銅)は農薬のほかに、顔料としても使用された。有機ヒ素化合物のメチルアルシン酸(MAA)やジメチルアルシン酸(DMAA)は除草剤に、フェニルアルソン酸塩などの芳香族ヒ素誘導体は家畜飼料の添加物として用いられている。
中毒症状・毒性
3価の無機ヒ素は、種々の生体細胞酵素の活性部分に存在するチオール基(SH基)と親和性が高く活性を阻害し、強い生体毒性を示す。5価の無機ヒ素の毒性は明確にされてないが、SH基との親和性が弱く体外排泄が速いことや毒性が発現する前に3価ヒ素へ還元される可能性が強いことから、3価ヒ素より毒性は弱いと考えられている。ヒ素はリン酸と化学的性質が類似しているため、競合やリン酸基との置換が起こり、その働きを阻害する。ヒ酸塩は酸化的リン酸化を脱共役することが示されている。
有機ヒ素化合物の毒性は、ラットを用いた急性毒性試験によると、MAAのLD50は2800mg/kgで、無毒と考えられる値である。一般に有機ヒ素化合物の毒性は弱い。
アルシンの毒性は溶血作用で、ほかのヒ素化合物にはみられない。赤血球に侵入したアルシンは過酸化脂質を生成し、これを無毒化するためにグルタチオンペルオキシダーゼが働き、還元型グルタチオンが消費される。そのため還元型グルタチオンによって維持されていた赤血球膜のNa‐Kポンプの平衡が崩れて赤血球中に多量のNaが流入し、溶血を起こす。
ヒ素中毒はその成因によって職業性と非職業性とに区別され、また曝露期間によって急性、亜急性、慢性中毒に分類される。急性ヒ素中毒は無機ヒ素による場合が多く、亜ヒ酸による服毒自殺や、無機ヒ素が混入した飲食物の摂取で発生している。臨床症状として、重篤な胃腸障害(腹痛、嘔吐)と頻脈を伴う。
慢性ヒ素中毒は、色素沈着症、角化症、多発性神経炎、気管支肺疾患、末梢循環障害などの症状が多発した。
代 謝
哺乳動物は一般に生体内で無機ヒ素のメチル化を行うことが知られている。メチル態のヒ素は低毒性であることから、無機ヒ素のメチル化は生体の解毒機構であると考えられる。メチル基転移反応は主に肝臓で行われると考えられている。また、5価の無機ヒ素より3価のほうが肝臓でのメチル化を受けやすい。メチルヒ素化合物から脱メチル化は起こらないと考えられている。
摂取と排泄については、特別な曝露のない場合、体内に分布するヒ素は食事を解して摂取される。日本人は1日に約200μgのヒ素を摂取しており、ヒ素の化学形態は食品によって異なるが、無機ヒ素はどの食品からも検出される。
ヒ素排泄の主ルートは腎臓で、そうヒ素排泄量の76%が尿中へ、残りは糞便中に排泄される。
放射性同位元素を用いた実験で、ヒ素はすべての組織に分布しており、組織別総ヒ素量としては筋肉が最も多いことがわかっている。無機、有機を問わず、ヒ素化合物を動物に経口投与すると、肺、腎、脾臓に蓄積が認められた。特に肺に顕著であった。5価の無機ヒ素は骨中のリン酸とヒ酸の置換が起こるため、骨にも蓄積する。3価ヒ素は毛や爪のSH基と結合して蓄積する。
食品衛生上の注意点
ヒ素は微量ながら多くの食品に含有されている。食品を湿式灰化後、あるいはヒ素定量装置で定量すると、値が得られるが、ヒ素は存在形態により毒性が大きく異なる。従って検出したヒ素の毒性評価をする場合、どのような存在形態であるかを留意する必要がある。
食中毒事例
1) 昭和23年5月 群馬県において「大福餅」により中毒。患者43名。症状は軽度の腹痛、嘔吐、吐き気を呈した。原因は餅の打粉にヒ素が混入していたためと判明した。
2) 輸入錐豆」による中毒。兵庫県において米の代替て配給されたビルマ産経豆により31名が中毒した。嘔吐、腹痛、下痢、けいれん等、この豆はサルタニ豆100g中49.6~52.9mgの亜ヒ酸を検出した。
3) 鳥取県の中学校において「ドーナツ」 により41名の生徒が食中毒。試験の結果、ドーナツからヒ素と鉛を検出。原因はメリケン粉に農薬のと酸鉛を混入したことによる。
昭和26年 1月 鳥取県において「ドーナツ」により41名が中毒を起こした。症状として頭痛、倦怠感がある。「ドーナツからヒ素が0.08%と鉛が検出され、原因は誤って農薬であるヒ酸鉛を混入したことによる。
昭和26年7月に広島県でヒ素による中毒があり20名が中毒を起こし、2名が死亡した。
水銀(mercury)Hg
来 歴
水銀は液体状金属で、おそらく紀元前15,6世紀には人類に知られており、鉛とともに最も古くから利用されていた金属である。
有機水銀には様々な化学形態があるが、環境暴露による健康影響という観点からはメチル水銀(MM)が重要である。
日本では熊本県水俣市で発生した「水俣病」が有名である。これは工場からメチル水銀が排水として流され、汚染された川の流域に住む住民が水、魚介類からメチル水銀を摂取したことによる公害である。
中毒症状・毒性
MMは全身的な毒性を持ち、曝露の量、期間に依存して、種々の器官や機能に影響を及ぼす。しかし、多くの動物系において主な標的器官は神経系であり、その症状は曝露後ある潜伏期間をおいて発現する。ヒトにおける症状は感覚鈍麻やしびれ感、言語障害、運動失調、視野狭窄、難聴などである。症状には多少の動物種差があるが、一般的なものとしては運動失調、歩行異常、四肢反射の異常、抹消知覚障害、感覚鈍麻などである。さらに、視覚障害や振戦がネコ、サルで観察されている。
発生、発育過程中の中枢神経系は、ほかの器官や組織に比べてMMに対する障害感受性が高い。MMは容易に胎盤を通過するため、母胎を通じて発生期、胎生期に曝露を受ける。
その他の臓器障害としては、まず腎障害があげられる。この腎障害はMMから生じた無機水銀により惹起されたとも考えられる。
代 謝
MMは消化管、呼吸器、皮膚から吸収されるが、環境曝露としては経口摂取が主として考えられる。消化管からの吸収率はヒトや動物のデータから95~100%とされている。MMの主な排泄経路は、糞便、尿、毛髪であり、動物種などにより差があるが、ヒトの主な排泄経路は糞便である。MMの生体内動態は主にシステイン化合物の濃度や代謝輸送と密接に関係している。MMは腸管では主にシステインと結合してアミノ酸の輸送系に依存して吸収される。血液中ではヘモグロビン、アルブミン、その他SH化合物と平衡関係により結合し、肝や腎では主にGSHや蛋白と結合した形で存在する。
腸内細菌により分解されて生じた無機水銀や剥離した腸上皮細胞に含まれる水銀が糞便として排泄される。
MMはCySMMとして脳血管関門と通過するが、このことが中枢神経毒性を惹起する大きな要因となっている。
食品衛生上の注意点
水銀の暫定基準値として魚介類に総水銀0.4ppm、カルメチル水銀0.3ppm(水銀として)がある。ただし、マグロ類(マグロ、カジキ及びカツオ)及び内水面水域の河川産の魚介類(湖沼の魚介類は含まない)、並びに深海性魚介類等(メヌケ類、キンメダイ、ギンダラ、ベニズアイガニ、エッチュウバイガイ及びサメ類)については適用しない。
クロム(chromium)Cr
来 歴
クロムは1798年にN.L.Vauquelinによって発見された。単体で天然に存在することはなく、複合した状態で地殻中に0.1~0.3ppm含まれる。クロム鉄鉱は、クロムの唯一の重要鉱石である。
エメラルド、蛇紋石、含クロム雲母の緑色や、ルビーの赤色はクロムによる。
ヒトの必須微量元素で、グルコース代謝に関係している。
クロムは通常3価か6価の状態で存在する。
中毒症状・毒性
6価クロムの有害作用には皮膚粘膜の刺激(炎症)と腐蝕(潰瘍形成)、感作(皮膚炎、喘息)、発癌(肺癌など)がある。皮膚、粘膜の腐蝕作用は6価クロムの強い酸化力によると考えられる。6価クロムは皮膚透過性が大きく、皮膚組織内で3価に還元され、感作を起こすと考えられている。
代 謝
6価クロム化合物のような水溶性化合物の粒子やミストは速やかに血液に取り込まれ臓器内に移行するが、不溶性粒子、たとえばクロム鉄鉱はマクロファージに取り込まれて徐々に除去される。
消化管での3価クロムの吸収率は非常に悪く、ラットで投与の1%以下、ヒトでは0.5%以下から3%の範囲、クロム酸塩(6価)の場合にはラットで3~6%、ヒトで約2%とされる。
クロムは新生児および成人のすべての器官に存在する。年齢別に見ると新生児で最も濃度が高いが、肺では20歳以降加齢とともに増加傾向を示す。これは大気中に存在するクロムが吸入され吸収されずに、そのまま肺胞に沈着するためと考えられる。通常、成人のクロム全身蓄積量は数㎎といわれ、臓器別の分布は、肺についで気管、小腸、大腸に多い。
生体内に取り込まれたクロムは尿および分から排泄され、尿からの排泄が主要な経路で、少なくとも80%が排泄される。糞便へのクロム排泄はヒトで投与量の0.5~20%とされている。
食品衛生上の注意点
現在の所大きな事故もないが、製造用具などにメッキをして事故を起こしたこともあることから食品用に用いないよう留意する必要がある。